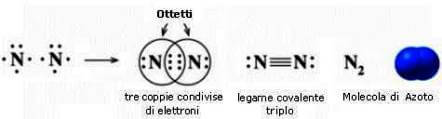
Due atomi possono tra loro condividere al massimo tre coppie di elettroni, creando così un legame triplo, come ad esempio tra atomi di azoto:
Esistono anche vari tipi di legame covalente che variano soprattutto dalla differenza di elettronegatività tra i due atomi coinvolti.
Elettronegatività = La capacità che un atomo possiede di attrarre verso di sé la coppia di elettroni messa in gioco in un legame chimico.
Gli elementi più elettronegativi sono fluoro,ossigeno, cloro e azoto mentre quelli meno elettronegativi sono francio (molto raro ) e cesio.
Legame covalente puro
Questo legame si ha solitamente tra elemento uguali, questo è un legame omopolare perchè la differenza di elettronegatività è pari a 0 e per cui le cariche negative e positive sono disposte in modo equo all'interno della molecola.
Legame covalente polare
Quando invece la differenza di elettronegatività è inferiore a 1,9 si ha un legame polare; qui si hanno però cariche positive o negative poste sui diversi atomi che per qui variano la geometria delle varie molecole.
Legame dativo
 |
| Ammonio |
www.wikipedia.org
Immagini prese da:
www.chimica-online.it; www.sapere.it
venus.unive.it; img545.imageshack.us


Nessun commento:
Posta un commento