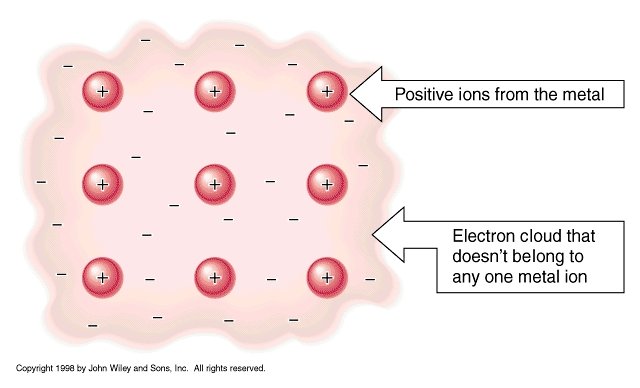
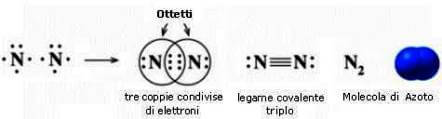
Questi legami, al contrario di quelli visti prima, si creano tra molecole e sono tutti legami , o meglio interazioni, ''uniti'' dalle forze di attrazione tra cariche positive e negative.... in particolari queste forze, che riguardano molecole polari ma anche apolari, sono dette Forze di Van der Waals.
 Quello che vedete a destra è un'interazione dipolo/dipolo ; questa si forma solo tra molecole polari che si stanziano a seconda delle cariche opposte presenti creando deboli campi magnetici che permettono l' ''unita'' della struttura della materia formata. Logicamente maggiori saranno le forze più la struttura sarà solida e difficile da scomporre.
Quello che vedete a destra è un'interazione dipolo/dipolo ; questa si forma solo tra molecole polari che si stanziano a seconda delle cariche opposte presenti creando deboli campi magnetici che permettono l' ''unita'' della struttura della materia formata. Logicamente maggiori saranno le forze più la struttura sarà solida e difficile da scomporre.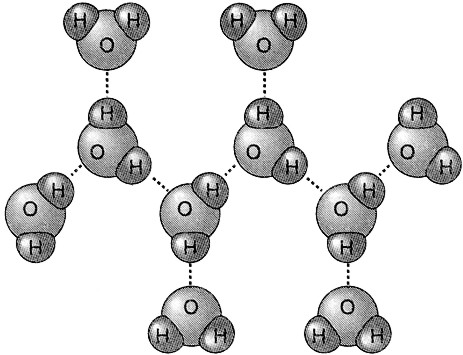 Esiste poi, molto importante,il legame idrogeno che si presenta tra idrogeno e elementi molto elettronegativi, come fluoro o ossigeno.
Esiste poi, molto importante,il legame idrogeno che si presenta tra idrogeno e elementi molto elettronegativi, come fluoro o ossigeno.Questo è simile all'interazione dipolo/dipolo ma molto più ''forte'' perchè l'idrogeno ha una forte carica positiva.
Logicamente questo spiega le proprietà dell'acqua, come l'alta viscosità o tensione superficiale ...
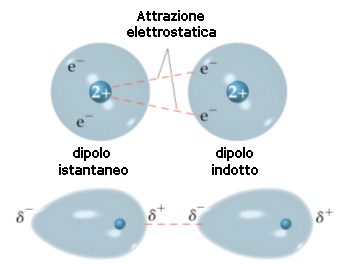 Infine esistono anche interazioni tra molecole non polari (dipoli istantanei): piccolissime variazione di posizione degli elettroni provocano anche uno spostamento delle cariche positive o negative che permettono così di creare, momentaneamente, interazioni tra i vari dipoli .... queste forze sono dette forze di London.
Infine esistono anche interazioni tra molecole non polari (dipoli istantanei): piccolissime variazione di posizione degli elettroni provocano anche uno spostamento delle cariche positive o negative che permettono così di creare, momentaneamente, interazioni tra i vari dipoli .... queste forze sono dette forze di London.
www.wikipedia.org
Immagini prese da:
www.larapedia.com
www.summagallicana.it
www.chimica-online.it